锂电知识必备——循环伏安法(CV)
锂电知识必备——循环伏安法(CV)循环伏安法(CV)是一种非常重要的电化学测试方法。随着锂电行业的快速发展,循环伏安在锂电池的研究中发挥着越来越重要的作用。该方法可用于探究电极反应
循环伏安法(CV)是一种非常重要的电化学测试方法。
随着锂电行业的快速发展,循环伏安在锂电池的研究中发挥着越来越重要的作用。
该方法可用于探究电极反应可逆性、电极反应机理及电极反应动力学等参数。
定义&原理
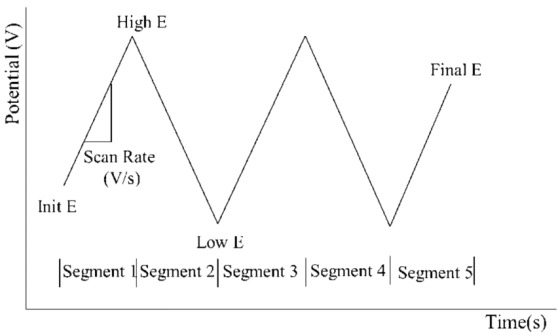
循环伏安法的激励信号图(图片来源江苏东华分析仪器有限公司公众号)
循环伏安法在电极上施加一个线性扫描电压,从起始电位以一定的速率扫描到一个顶点电位,再从该顶点电位扫描到另一个顶点电位的两阶段,此扫描可以在两个顶点电位之间多次重复(输入信号如上图所示)。
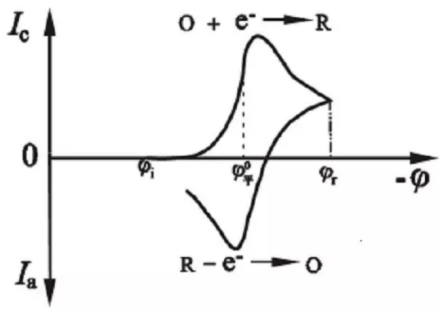
循环伏安电压电流响应曲线(图片来源材料人公众号)
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线(输出信号如上图所示)。
循环伏安图峰的来源有哪些?
1.双电层的影响循环伏安测得的电流响应一般为法拉第电流和非法拉第电流。由于扫描电位在持续改变,因此,总有电流对双电层充电,非法拉第电流总是存在。在没有电化学反应的电位区间,测得的电流即为用于电极双电层充电的非法拉第电流;在电极电化学反应的电位区间,由于加入了法拉第电流,通过电极的电流会明显增大,从而形成峰。
2.电极反应为O+ne-=R。当初始反应物中只有O而没有R,且扫描的起始电势比O/R体系的标准平衡电势更正时,开始扫描一段时间内电极上只有不大的充电电流通过。当电极电势接近平衡电极电位时,O开始在电极上还原,并随着电势变负出现越来越大的还原电流。当还原电势显著超越平衡电极电位后,又因表面层中反应物的消耗使电流下降,从而形成峰。反向扫描时又得到氧化电流的峰值。
循环伏安法的应用
可逆性的判断
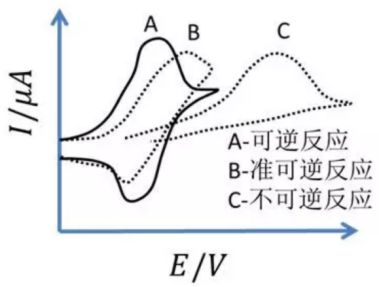
可逆/准可逆/不可逆过程的循环伏安图(图片来源研之成理公众号)
从循环伏安图的氧化和还原两个方向得到的氧化峰和还原峰的峰高和对称性可以判断出电极活性物质在电极表面反应的可逆程度。
若反应可逆,则曲线上下对称(A曲线);若反应不可逆,则曲线对称性较差且氧化还原峰的高度不同。
判断电极表面反应类型
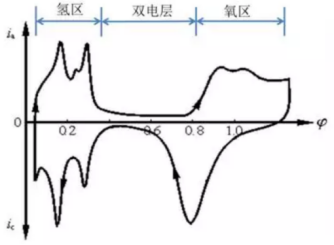
Pt在硫酸溶液中的循环伏安图(图片来源研之成理公众号)
除此之外,研究者也会通过CV曲线来推断电极的反应机理,这也是循环伏安在锂电池的主要应用。当对正负极或电解液等材料进行改进或者替代时,搞清楚其中的反应机制是十分必要的,该方法也是对于一个新的电化学体系首选的研究方法。
关于循环伏安法的几个问题
1.为什么需要参比电极?
当知道工作电极相对于参比电极的电势差后也就间接知道了电极和溶液之间界面的电位差。所以,当我们控制了工作电极相对于参比电极的电势差时也就间接控制了电极和溶液之间界面的电势差。
2.电解池测三电极时需要注意什么?
利用电解池进行循环伏安时,工作电极与对电极之间的距离保持一定。参比电极与工作电极之间距离尽量靠近。工作电极、对电极和参比电极保持固定。
3.哪个是氧化峰,哪个是还原峰?
电位高的是氧化峰;电位低的是还原峰。
4.为什么有的峰没出完全?
一个原因是电位范围过窄,氧化反应没发生完全就已经进行下一段回扫。
二是扫描速率过大,氧化峰向更正电位进行了大范围移动,所以在相同电位范围内,氧化峰显示不完全。
5.扫描速率如何确定呢?
如果只是探究电极上发生的氧化还原反应,扫速小于应1mV/s,此时,电极表面可视作稳态过程。
若要同时考察非法拉第电流占比,扫速可增大,此时峰位在电极内阻的作用下会发生相应的移动,且矩形部分占比增加,部分氧化还原峰会被掩盖掉。
6.当利用电解池进行循环伏安时电解液会变色?
这是由于电极上发生的氧化还原反应。如果电极表面物质附着不牢固,会有离子溶入电解液中,从而造成电解液变色。
当然,利用电化学工作站进行循环伏安的测试还是很简单的。重要的是,对数据进行解析,才能发挥循环伏安测试最大的用处。
上一篇:欣旺达凭什么拿下“蔚小理”?
