CDE发布《真实世界证据支持药物研发的基本考虑》意见稿,用以评价药物的有效性和安全性
CDE发布《真实世界证据支持药物研发的基本考虑》意见稿,用以评价药物的有效性和安全性5月29日,动脉新医药获悉,国家药品监督管理局药品审评中心组织起草发布了《真实世界证据支持药物研
5月29日,动脉新医药获悉,国家药品监督管理局药品审评中心组织起草发布了《真实世界证据支持药物研发的基本考虑(征求意见稿)》。为鼓励研究和创制新药的要求,考虑到药物临床研发过程中,存在临床试验不可行或难以实施等情形,利用真实世界证据用以评价药物的有效性和安全性成为可能的一种策略和路径。
2019年4月4日,FDA基于真实世界数据(RWD, real world data)批准了辉瑞的爱博新(Ibrance)一项新适应症:与芳香化酶抑制剂或氟维司群(fulvestrant)联合,可用于治疗患有HR +、HER2-转移性乳腺癌的男性患者。
FDA此次批准主要基于美国电子健康记录数据,以及IQVIA保险数据库、肿瘤大数据公司Flatiron的乳腺癌数据库、辉瑞全球安全性数据库收录的Ibrance上市后在真实世界的男性患者的用药数据,而非临床试验或临床表现评价。通常来说,FDA对药物的审批是基于其开放性Ⅲ期临床试验,但对病例非常少见且疗效相当显著的药物,也可以单臂试验作为审评依据,即使是生物类似药的审批,也需要严格的等效临床表现评价。这是FDA首次基于真实世界数据审批的药物适应症,。
美国FDA在《21世纪治愈法案》的推动下,在2017-2018年先后发布了《使用真实世界证据以支持医疗器械监管决策》、《临床研究中使用电子健康档案数据指南》和《真实世界证据计划的框架》等文件。
药物研发过程中,对于某些缺乏有效治疗措施的罕见病和危及生命的重大疾病等情形,常规的临床试验可能难以实施,或需高昂的时间成本,或存在伦理问题,因此近年来如何利用真实世界证据用以评价药物的有效性和安全性,成为国内外药物研发中日益关注的热点问题。
《真实世界证据支持药物研发的基本考虑(征求意见稿)》定位于支持药物研发,且基于以上背景和现有经验,提出基本考虑,旨在厘清药物研发中真实世界研究的相关定义,明确真实世界证据在药物研发中的地位和适用范围,探究真实世界证据的评价原则,以期为工业界利用真实世界证据支持药物研发提供科学可行的指导意见。
本指南的起草小组基于药审中心与南方医科大学战略合作建立的三方学术协调委员会,由学术界、制药工业界和监管机构代表共同组成,保证了本指南高效、高质量完成。本指南自2018年11月正式启动,分别于2019年1月12日和3月30日召开研讨会,历时6个月最终形成该征求意见稿,完整内容如下:
真实世界证据支持药物研发的基本考虑
一、 引言
1背景与目的
随机对照临床试验(Randomized Controlled Trial,RCT)被认为是评价药物有效性的“金标准”,并为药物临床试验普遍采用。RCT严格控制试验入组与排除标准和其它条件,并进行随机化分组,因此能够最大限度地减少影响因果推断的因素,使得研究结论较为确定,所形成的证据可靠性也较高。但RCT亦有其局限性:严苛的入排标准可能会使试验人群对目标人群的代表性变差;所采用的标准干预与临床实践用药不完全一致;有限的样本量和较短的随访时间导致对罕见不良事件探测不足等。这些局限性使得RCT的研究结论外推于实际临床应用时面临挑战。此外,对于某些缺乏有效治疗措施的罕见病和危及生命的重大疾病,常规RCT或难以实施,或需高昂的时间成本,或可能引发伦理问题。因此,在药物研发领域如何利用真实世界证据(Real World Evidence,RWE),或者将其作为RCT的辅助证据,用以评价药物的有效性和安全性,已成为全球相关监管机构、制药工业界和学术界共同关注且极具挑战性的问题。
首先,我们需要从概念上厘清真实世界证据的定义和内涵。
其次,作为真实世界证据基础的真实世界数据(Real World Data,RWD),其能否、或如何起到充分的支撑作用,涉及诸多亟待商榷的问题,包括数据来源、数据标准、数据质量、数据共享、数据的基础建设等。
其三,监管法规的真空。目前国际上尚无成熟的相关法规出台,在没有成熟经验的情况下,如何制定适合我国制药行业现实的指南需要积极的探索研究和创新。
其四,评价真实世界证据的方法学有待规范。真实世界证据源于对真实世界数据的正确和充分分析,所采用的分析方法主要是因果推断方法,涉及较复杂的模型与模型假设、相应的协变量筛选、混杂因素识别、中间变量及工具变量定义等,这对统计分析人员提出了更高的要求,也对法规的制定提出了迫切需求。
其五,真实世界证据的适用范围有待明确。真实世界证据的主要作用是与传统临床试验提供的证据互为补充,综合形成完整而严谨的证据链,提高药物研发的科学性和效率,而非替代之。因此,需要根据药物研发的现实情况明确真实世界证据的适用范围,并能够随现实情况变化进行调整。
鉴于上述原因,本指南旨在厘清药物研发中真实世界研究的相关定义,明确真实世界证据在药物研发中的地位和适用范围,探究真实世界证据的评价原则,以为工业界利用真实世界证据支持药物研发提供科学可行的指导意见。
2国内外监管机构在法规或指南制定方面的进展
2009年2月美国的经济复苏刺激法案(The American Recovery and Reinvestment Act)对实效比较研究(Comparative Effectiveness Research,CER,见词汇表)起到了巨大推动作用。基于CER的真实世界环境的背景,真实世界研究(Real World Research/Study,RWR/RWS)的概念被提出。
美国于2016年12月通过《21世纪治愈法案》(21st Century Cures Act),旨在鼓励美国食品药品监督管理局(the Food and Drug Administration,FDA)开展研究并使用真实世界证据以支持药物和其它医疗产品的监管决策,加快医药产品的开发。在该法案的推动下,2017-2018年FDA先后发布了《使用真实世界证据以支持医疗器械监管决策》、《临床研究中使用电子健康档案数据指南》和《真实世界证据计划的框架》。
欧盟药物管理局(European Medicines Agency,EMA)在2013年发布了《阿尔茨海默病疾病进展和临床试验评估的数据驱动模型新方法的意见书》,讨论了利用真实世界中观察性数据建立疾病进展模型的技术细节。EMA于2014年启动了适应性许可试点项目(Adaptive Licensing Pilot),用以评估利用观察性研究数据辅助决策的可行性。2016年11月发布了《药物上市后有效性评价科学指南》。
日本医药品医疗器械综合机构(PMDA)在人用药品技术要求国际协调理事会(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)层面提出更高效利用真实世界数据开展上市后药物流行病学研究技术要求新议题的国际协调。
我国系统性开展使用真实世界证据支持药物研发和监管决策的工作尚处于起步阶段。国家药监机构在审评实践中已经开始应用真实世界证据,例如2018年批准的扩展贝伐珠单抗(Bevacizumab)联合以铂类为基础的化疗方案,采用三项回顾性研究结果作为真实世界证据支持最终决策。另一个案例是某药上市后开展前瞻性、观察性真实世界研究,以提供更充足的有效性和安全性证据。
二、 真实世界研究的相关定义
广义的真实世界研究既包括以自然人群为对象的研究,也包括以临床人群为对象的研究;后者所得到的真实世界证据既可用于支持医疗产品研发与监管决策,也可用于其它科学目的。本指南仅限于用于支持医疗产品研发与监管决策的真实世界研究(见下图)。
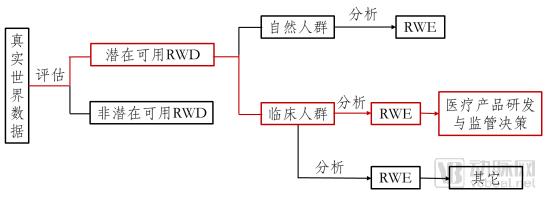
图1从RWD到支持医疗产品监管决策RWE的路径
我们将真实世界研究定义为:在真实世界环境下收集与患者有关的数据(真实世界数据),通过分析,获得医疗产品的使用价值及潜在获益或风险的临床证据(真实世界证据),其主要研究类型是观察性研究,也可以是实用临床试验。
1真实世界数据
(1) 定义
美国联邦食品、药品和化妆品法案(FD&C Act)第505F(b)条将真实世界数据定义为“来源于传统临床试验以外的,关于药物使用或潜在获益、风险的数据”。FDA在《真实世界证据方案的框架》和《使用真实世界证据以支持医疗器械监管决策》中将真实世界数据定义为“与患者健康状况有关的和/或日常医疗过程中收集的各种来源的数据”。例如,电子健康档案(Electronic Health Record, EHR)数据、电子病例(Electronic Medical Record,EMR)数据、医保数据(Medical Claims Data)、产品和疾病登记中心的数据、患者报告数据(包括居家环境)、其它健康检测(如移动设备)的数据等。
我们将真实世界数据定义为:与患者使用药物以及健康状况有关的和/或来源于各种日常医疗过程所收集的数据。
(2) 真实世界数据的来源
国内真实世界数据的常见来源包括:
1)卫生信息系统(Health Information System,HIS):类似于EMR/HER,包括结构化和非结构化数据字段的数字化患者记录,如患者的人口学特征、临床特征、诊断、治疗、实验室检查、安全性和临床结局等。
2)医保系统:包含有关患者基本信息、医疗服务利用、处方、结算、医疗索赔和计划保健等结构化字段的数据。
3)疾病登记系统:特定疾病(通常是慢性病)患者的数据库,通常来源于医院的疾病人群队列登记。
4)国家药品不良反应监测哨点联盟(CASSA):利用医疗机构电子数据建立药品及医疗器械安全性的主动监测与评价系统。
5)自然人群队列数据库:国内已经建立或正在建立的自然人群队列和专病队列数据库,可成为潜在的真实世界数据。
6)组学相关数据库:采集患者的生理学、生物学、健康、行为和可能的环境相互作用的组学相关信息,如药物基因组学、代谢组学和蛋白质组学的数据库。
7)死亡登记数据库:由医院、疾病预防控制中心,和户籍部门联合确认的死亡登记所形成的数据库。
8)来自移动设备端的数据:应用移动设备,如可穿戴设备,检测受试者获得的相关数据。
9)其他特殊数据源:为特殊目的创建的数据库,如国家免疫规划数据库等。
(3) 数据质量评价
真实世界数据的质量主要通过其相关性和可靠性进行评估。
1)相关性:评估真实世界数据是否适合监管用途的重要相关因素包括但不限于:
①是否包含与临床结局相关的重要变量和信息,如药物使用、患者人口学和临床特征、协变量、结局变量、随访时间、样本量等;
②临床结局定义是否准确,相应的临床意义是否明确;
③目标人群定义是否准确、具有代表性;
④研究方案和统计分析计划是否满足对研究假设的验证。
2)可靠性:真实世界数据的可靠性主要从数据的完整性(Completeness)、准确性(Accuracy)、质量保证(Quality Assurance)和质量控制(Quality Control)方面进行评价。
①完整性:真实世界数据无法避免数据缺失问题,但缺失比例应该有一定的限度。对于不同研究,数据的缺失程度可能会有不同,当特定项目的数据缺失比例超过一定限度时,会使研究结论有很大的不确定性,此时,需要慎重考虑该数据能否作为支持产生真实世界证据的数据。
②准确性:数据的准确性极为重要,需要依据较权威的参照来源进行识别和验证。例如,血压的测量需要使用校准过的血压计,且测量过程需遵循操作规范;终点事件是否经独立的终点事件委员会做出判断等等。
③质量保证:质量保证是指预防、探测和纠正研究过程中出现的数据错误或问题的措施。质量保证与监管合规性(Regulatory Compliance)密切相关,应贯穿于数据管理的每一个环节,作为最基本的要求,数据管理的每一环节必须制定相应的标准操作规程(Standard Operation Procedures, SOPs)。
④质量控制:数据的采集、修改、传输、保存和归档,以及数据的处理、分析和提交等每一个环节均需进行质量控制,以保证真实世界数据的准确性和可靠性。对此有必要制定一个完整、规范、可靠的数据管理流程或方案。
(4) 数据标准
数据标准使递交的资料具有可预测性和一致性,并具有信息技术系统或科学工具可使用的形式。为了使多个来源的真实世界数据协同工作,需将数据转换成通用格式,具有通用表述形式(如术语、词汇表、编码方案等)。
此外,真实世界数据的质量是否可以支持药物研发需考虑的重要因素还包括(但不限于):数据采集是否有明确流程和合格人员;是否使用了共同的定义框架,即数据字典;是否遵守采集关键数据点的共同时间框架;是否建立与收集真实世界数据有关的研究计划、协议和/或分析计划的时间安排;用于数据元素捕获的技术方法是否充分,包括各种来源数据的集成、药物使用的数据记录、与索赔数据的链接等;患者的选择是否将偏倚最小化以体现真正的目标人群;数据输入、传输是否具有可用性和及时性;是否有充分和必要的患者保护措施,如患者隐私保护和符合监管规定的知情同意。
2 真实世界证据
真实世界证据是通过对真实世界数据的分析获得的关于医疗产品的使用情况和潜在获益或风险的临床证据。该定义在概念上不限于通过回顾性观察研究获得证据,还允许前瞻性地获取更广泛的数据以形成证据,特别是包括实用临床试验(Pragmatic Clinical Trial, PCT)一类的研究设计。
首页 下一页 上一页 尾页
无相关信息